电流通过化学电池在电极上发生电子转移的化学反应过程叫电解。图1.2是一典型的电解装置
在CuSO4溶液中插入两支铂电极,逐渐增加两电极间的电压,开始阶段,随着外加电压的升高,两电极间只有很小的电流通过,当外加电压升至某一数值之后,则随着电压的升高电流急剧增加,这一电压称为分解电位。此时电极反应如下:
阴极
阳极
由于电解过程的迅速进行,两极间产生较大电流。随着电解时间的延长,电活性物质浓度降低,通过电解池的电流就逐渐减小,为了使电解电流保持恒定,必须使电解池的电压调到更负。当阴极电位负到一定值时,第二个电活性物质又开始在电极上析出。如果在酸性溶液中继续不断的电解下去,将使氢在阴极上析出,阴极电位将相对的稳定在氢析出电位上。如果在电解过程中控制阴极电位在某一预定值上,此
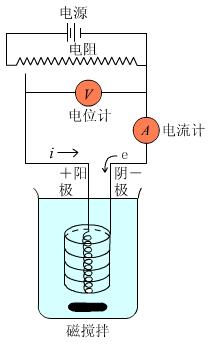 图1.2电解装置
图1.2电解装置